| 乙肝病毒前核心蛋白调节机体对核心抗原的免疫应答 | 您所在的位置:网站首页 › hb cag的编码区为 › 乙肝病毒前核心蛋白调节机体对核心抗原的免疫应答 |
乙肝病毒前核心蛋白调节机体对核心抗原的免疫应答
|
作为慢性HBV感染的模型,TCR×HBc/HBeAg 转基因小鼠被用于探究持续的抗原暴露对T细胞的影响。7/16-5 Tg TCR (Vβ11⁺-Vα5⁺)对 HBc/HBeAgs的120–140残基特异,受I-Aᵇ MHC II类分子限制, 表达于53%的CD4⁺ T 细胞。在该研究中,六只表达HBc/HBeAg特异性7/16-5 TCR和HBcAg(7/16-5×HBc)的双转基因小鼠在4至6周龄时全部自发血清转换为抗-HBc IgG抗体阳性(图1),产生了所有IgG亚型的抗-HBc抗体;丰富程度从高到低依次为IgG2b、IgG2a、IgG1和IgG3。在7/16-5×HBc 双转基因小鼠中自发的抗-HBc血清转换表明,HBcAg没有耐受性,而是在体内充当7/16-5 T细胞的免疫原。由于颗粒状HBcAg在B细胞水平上具有极高的免疫原性,因此从肝细胞中“泄漏”出来的少量的这种胞内抗原足以引起自发的抗-HBc血清转换。 相比之下,在7/16-5×HBe双转基因小鼠中,不会引起自发的HBeAg向抗-HBe (IgG抗体)血清转换,表明7/16-5 T细胞可以耐受血清HBeAg。通过繁殖能够同时表达7/16-5 TCR、HBcAg和HBeAg的三联转基因小鼠,以确定在对HBcAg的免疫原性应答和对HBeAg的耐受性应答之间,谁会占据主导地位。在六只7/16-5×HBc×HBe 三联转基因小鼠中,血清中的HBeAg(4-10μg/mL)阻止了其中两只的自发抗-HBc IgG抗体血清转换,并在其余四只小鼠中显著抑制抗-HBc IgG抗体的产生(图1)。三联转基因小鼠产生的抗-HBc不但抗体低水平,并且抗体出现时间延迟、 IgG亚型有限。据此可见,血清HBeAg是作为一种免疫调节蛋白在体内下调对HBcAg的体液反应。
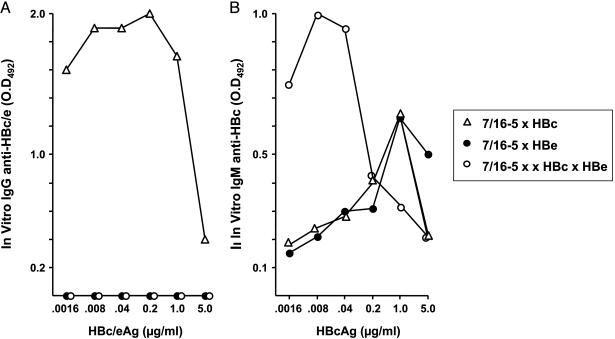
图1. 血清HBeAg抑制抗-HBc自发血清转换。每组6只7/16-5×HBc双(dbl)转基因小鼠和7/16-5×HBc×HBe三联(tri)转基因小鼠,3至28周龄之间取血,收集血清,并通过ELISA测定抗-HBc抗体的总IgG和IgG亚型。通过终点稀释血清定量检测抗-HBc抗体。符号代表单独的小鼠。7/16-5 Tg TCR(Vβ11⁺-Vα5⁺)对HBc / HBeAgs的120-140残基具有特异性,受IA ᵇ MHC II类分子限制,并在53%的CD4⁺ T细胞上表达。对照HBcAg单转基因小鼠未自发产生抗-HBc抗体。 分离7/16-5×HBc、7/16-5×HBe 双转基因和7/16-5×HBc×HBe三联转基因小鼠的脾细胞,在存在HBcAg或HBeAg的条件下进行体外培养。在脾脏原代培养中,7/16-5×HBc脾细胞产生大量抗-HBc IgG抗体,而7/16-5×HBe双转基因脾细胞未产生抗-HBe IgG抗体,且三联转基因脾细胞也未产生抗-HBe IgG抗体(图2 A)。体外脾脏原代培养物中IgG抗体的产生与体内抗-HBc/e IgG抗体的产生平行(图1)。体外7/16-5×HBe双转基因脾细胞未产生抗-HBe IgG抗体,证明在体内检测不到自发抗-HBe IgG抗体不是由于免疫复合物或血清HBeAg对抗-HBe的掩盖。 接着检测脾脏培养上清液中是否有抗-HBc IgM抗体的产生。如图2 B所示,所有7/16-5 TCR⁺ 双转基因和三联转基因小鼠的脾细胞在与HBcAg原代培养后均产生抗-HBc IgM抗体(7/16-5 TCR单转基因脾细胞在与HBcAg原代培养后也产生了抗-HBc IgM抗体),值得注意的是7/16-5×HBc×HBe三联转基因小鼠的脾细胞在体外不产生抗-HBc IgG抗体,而会产生高水平的抗-HBc IgM抗体。与7/16-5×HBc双转基因脾细胞相比,7/16-5×HBc×HBe三联转基因脾细胞中抗-HBc IgG抗体和抗-HBc IgM抗体的生成分别被抑制和增强。由此可以推断, 在HBeAg存在时,在产生的抗体从抗-HBc IgM转变为IgG的过程中,Th的重要性降低了;并且,在HBeAg存在的同时又有Th功能不足时,HBcAg一般会诱导产生更多的抗-HBc IgM抗体。这一发现可能与在慢性HBV患者中经常观察到的抗-HBc IgM抗体的周期性复发有关。
图2. 7/16-5 TCR⁺ 双转基因和三联转基因小鼠脾细胞体外抗-HBc/e抗体的产生。向来自7/16-5×HBc和7/16-5×HBe双转基因小鼠以及7/16-5×HBc×HBe三联转基因小鼠的脾细胞加入不同浓度的重组HBcAg或HBeAg,培养5天。收集培养物上清液,并通过ELISA确定IgG(A)和IgM(B)抗-HBc / e抗体的产生。分析未稀释的培养物上清液,并将结果表示为OD₄₉₂ 值,减去从无抗原的培养基对照孔中获得的背景OD₄₉₂ 值进行校正。符号代表单独的小鼠,并且结果代表每组至少五只小鼠。 之前对HBeAg下调抗-HBc血清转换的简单解释是:由于氨基酸序列的高度同源性,血清HBeAg可能在检测中掩盖了抗-HBc抗体。然而,实际上将HBeAg-Tg小鼠的血清添加到抗-HBc抗体的稀释液中不会影响抗-HBc抗体的检测。对7/16-5×HBc×HBe三联转基因小鼠抗-HBc产生减少的第二个可能解释是:表达两种转基因的小鼠肝脏中的HBcAg含量较低。尽管HBc/HBe双转基因小鼠细胞内HBcAg的表达往往比HBc单转基因小鼠约少一半,但抗-HBc血清转换与肝脏中HBcAg含量之间没有相关性,表明低浓度HBcAg浓度(0.2-2.0μg/ mg肝蛋白)并不是限制抗-HBc抗体产生的原因。 血清HBeAg可激发7/16-5 TCR-Tg T细胞耐受 因此,分泌的HBeAg(而非细胞内HBcAg)能引起7/16-5 T细胞的耐受/无能,血清HBeAg在T细胞水平通过这种方式下调7/16-5×HBc×HBe三联转基因小鼠的自发抗-HBc血清转换。此外,体内激活的7/16-5 T细胞介导7/16-5×HBc双转基因小鼠的肝损伤,但是在7/16-5×HBc×HBe 三联转基因小鼠中存在的血清HBeAg可显著减轻肝损伤。因此, 血清HBeAg的免疫调节作用不仅局限于抑制抗-HBc抗体的产生,还影响HBcAg特异性CD4⁺ T细胞介导的肝损伤。这些结果表明,分泌形式的核蛋白在患者体内的功能是作为有效的T细胞耐受原,下调宿主对细胞内表达的HBcAg的免疫应答。
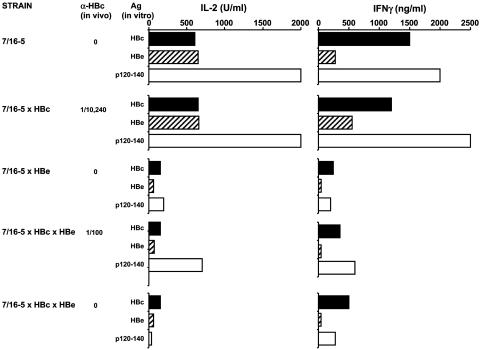
图3. 血清HBeAg 在7/16-5 T细胞中引起体内耐受/无能。用HBc/HBeAgs(1.0μg/mL)培养7/16-5 TCR单转基因、7/16-5×HBc双转基因、7/16-5×HBe双转基因或三联转基因小鼠的未接触抗原的脾细胞(5×10⁶ /mL),分别在第2天和第4天检测培养上清液中产生的IL-2和IFN-γ细胞因子。每只小鼠体内抗-HBc IgG抗体血清滴度均已标示。数据来自单只小鼠,至少代表三次独立实验。 在7/16-5 TCR-Tg T细胞中诱导T细胞 耐受/无能取决于激活状态并且可逆
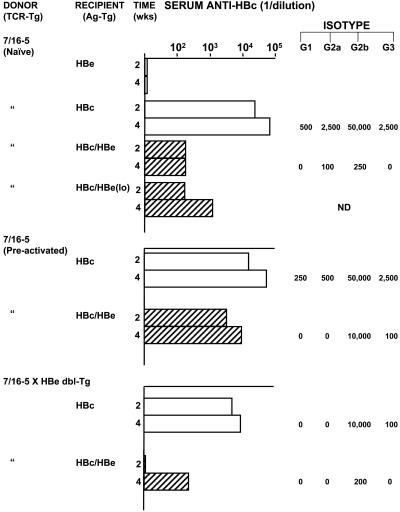
图4. 诱导7/16-5 T细胞耐受/无能取决于T细胞的活化状态,并且可逆。将来自7/16-5 TCR Tg小鼠的,含有约3×10⁶ TCR⁺ CD4⁺ T细胞的供体脾细胞(30×10⁶)过继转移到CD4 / CD8清除的HBcAg或HBeAg单转基因,和HBc/ HBeAg双转基因受体小鼠中(每组三只受体小鼠)。供体脾细胞包含初始7/16-5 T细胞、使用p120-140(1.0μg/mL持续3天)体外预激活的7/16-5 T细胞,或从7/16-5×HBe双转基因小鼠提取的7/16-5 T细胞。转移后第2和第4周,给受体小鼠取血,并通过ELISA测定抗-HBc抗体的总IgG和IgG亚型。在用初始7/16-5 T细胞(第1组)过继转移的HBeAg-Tg受体小鼠中,测定了抗-HBe IgG抗体。对每组三只受体小鼠的合并血清进行总抗-HBc IgG抗体测定和IgG分型。 前述实验通过转移天然7/16-5供体脾细胞进行。将预激活的7/16-5供体脾细胞(即用p120-140培养)转移到HBc/e双转基因受体中,与转移初始脾细胞相比,体内产生的抗-HBc抗体增加到50倍(1:10,000滴度)(图4)。因此,活化的7/16-5 T细胞对受体中血清HBeAg诱导的耐受较不敏感。为了确定7/16-5×HBe双转基因小鼠中7/16-5 T细胞的无能状态是否可逆,将双转基因供体中提取的脾细胞也转移到HBcAg或HBc/HBe双转基因受体中。转移到HBc / HBe 双转基因小鼠体内几乎不会产生抗-HBc抗体,而转移到HBc单转基因小鼠中则会导致抗-HBc抗体的产生(1:10,000滴度)(图4)。转移到HBc-Tg受体中的无能的7/16-5供体T细胞诱导产生的抗-HBc抗体水平是初始7/16-5供体T细胞对应水平的10%,特定的IgG亚型水平仍为阳性,表明体内暴露于血清HBeAg的7/16-5 T细胞的耐受状态至少可在没有耐受原(即HBeAg)的情况下逆转或发生改变。 在该系统中,HBeAg介导的T细胞耐受是非清除性的,并且在没有耐受原(HBeAg)的情况下是可逆的,因此最好将其描述为体内无能或适应性耐受。 总结 HBeAg和HBcAg不同的T细胞耐受性和HBeAg的免疫调节功能,对围生期和成人HBV感染,特别是HBeAg突变的病毒感染具有重要的意义。前核心区和核心启动子区的常见突变分别消除和减少了HBeAg的生成。以上小鼠研究表明,依据HBeAg在天然HBV感染中具有免疫调节作用的前提推断,则可以预测前核心区(preC)或核心启动子(BCP)突变病毒的感染可能导致抗病毒免疫应答增强和慢性化概率降低。临床证据与该预测基本一致,HBeAg阳性野生型HBV感染的新生儿主要(90%)变为慢性感染,而感染HBeAg阴性突变病毒的新生儿经历短暂急性感染,常伴随暴发性肝炎。同样,HBeAg阴性的突变病毒感染成年人时常引起急性暴发性肝炎。此外, 在慢性HBV感染期间HBeAg阴性突变病毒的出现,可以在某些情况下导致肝损伤和预后不良的恶化,在高病毒载量时若HBeAg阴性突变体成为主要的病毒形式更值得警惕。因此,血清HBeAg充当T细胞耐受原和下调针对HBcAg的免疫应答的能力可能在急性感染期间缓解HBcAg特异性肝损伤,并在慢性感染期间促进和维持病毒持续性感染,这也许可以解释前核心和核心启动子区突变与严重的肝脏疾病之间的关联。 尽管7/16-5 TCR谱系代表单HBeAg特异性T细胞克隆,对耐受/无能非常敏感,但已经证明血清HBeAg可能通过克隆清除、Fas介导的细胞凋亡以及在另外两种TCR-Tg谱系和HBeAg-Tg小鼠中的克隆忽视,诱导T细胞耐受。因此,就诱导机制而言,对HBeAg的T细胞耐受是克隆性和异质性的,即使在单个HBV感染患者中,这种异质性也很明显。由于在野生型HBV感染期间免疫原(HBcAg)和耐受原(HBeAg)的同时存在,因此在各个阶段,耐受的、静止的和激活的HBc/HBeAg特异性T细胞克隆之间的平衡(即慢性感染的“耐受”和“清除”阶段)可能是病毒清除和免疫介导的肝损伤的重要决定因素。与HBc/HBe-Tg小鼠联合的7/16-5 TCR-Tg谱系是非常有用的模型,因为它可以自发出现抗-HBc血清转换。HBeAg和HBcAg耐受性的不同非常明显;HBeAg诱导的T细胞耐受由体内克隆无能调控,而非克隆清除。如果在自然的慢性HBV感染过程中存在7/16-5样T细胞,它们可能会通过逆转无能状态而变得易于激活。在没有耐受原时,HBeAg特异性T细胞耐受是可逆的,这表明 降低HBeAg载量和病毒载量的抗病毒治疗,可能与HBc/HBeAg特异性免疫相结合,有效治疗慢性HBV感染。此外,这种TCR/Ag双转基因和三联转基因模型可用于筛选免疫调节药物以逆转体内HBeAg特异性T细胞耐受。 文献来源: 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】